植入和介入到血管内的无菌医疗器械对GMP车间洁净度级别的要求
发布时间:2024-10-31浏览:2799
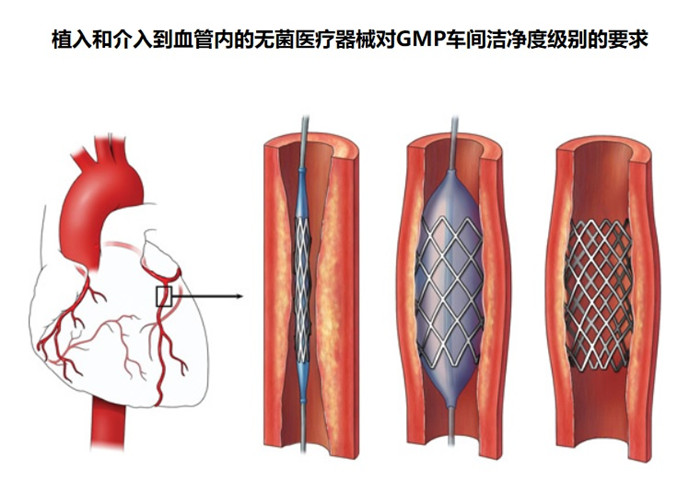
由于植入和介入到血管内的医疗器械的高风险,及医疗器械的安全性要求,植入和介入到血管内的无菌医疗器械注册产品需要在洁净车间生产,那法规有没有明确要求是10万级洁净车间还是万级洁净车间,一起看正文。
植入和介入到血管内的无菌医疗器械对GMP车间洁净度级别的要求
根据《医疗器械生产质量管理规范无菌医疗器械现场检查指导原则》,植入和介入到血管内的无菌医疗器械及需要在10,000级下的局部100级洁净室(区)内进行后续加工(如灌装封等)的无菌医疗器械或单包装出厂的配件,其末道清洁处理、组装、初包装、封口的生产区域和不经清洁处理的零部件的加工生产区域应当不低于10,000级洁净度级别。
如有无菌检验员培训报名需求,欢迎您随时方便与检验员培训网联络,联系人:吕工,电话:18868735317,微信同。